De balans opmaken van Idebenone
Door Peter Makai PhD en Christina Barckhausen PhD
Idebenone is een geregistreerd geneesmiddel voor de ziekte Leber hereditary optic neuropathy (LHON), die vergelijkbaar is met ADOA. Idebenone is daarom een van de oudste en aantoonbaar veilige medicijnen om de progressie van ADOA te vertragen. ADOA-patiënten krijgen dit medicijn in sommige landen, zoals Duitsland, via een zogenaamde off-labelprocedure. Maar niet in andere landen zoals het Verenigd Koninkrijk, Nederland of Zweden. Daar is Idebenone vaak verkrijgbaar als voedingssupplement. Een van de meest gestelde vragen bij de Cure ADOA Foundation is of patiënten Idebenone moeten nemen.
In dit artikel zullen we het onderzoek naar Idebenone inventariseren en hopelijk kan dit patiënten helpen om met hun arts te praten als ze met deze vraag rondlopen.
Hiervoor moeten we kijken naar hoe OPA1-mutaties mitochondriën beschadigen. Dit wordt uitgelegd in Figuur 1. Mitochondriën bevatten twee membranen, het binnenste en het buitenste mitochondriale membraan. De belangrijkste functie van OPA1 is de organisatie en vernieuwing van het binnenste mitochondriële membraan, waar bijvoorbeeld energie voor de cellen wordt geproduceerd. Het energiemolecuul ATP wordt geproduceerd in de langgerekte buisjes in de mitochondriën, door zogenaamde mitochondriale energieproducerende complexen. Als OPA1 defect is, is het binnenste mitochondriale membraan “ontregeld” wat de ATP = energieproductie drastisch belemmert. Met andere woorden, het belemmert de cellulaire energieproductie.
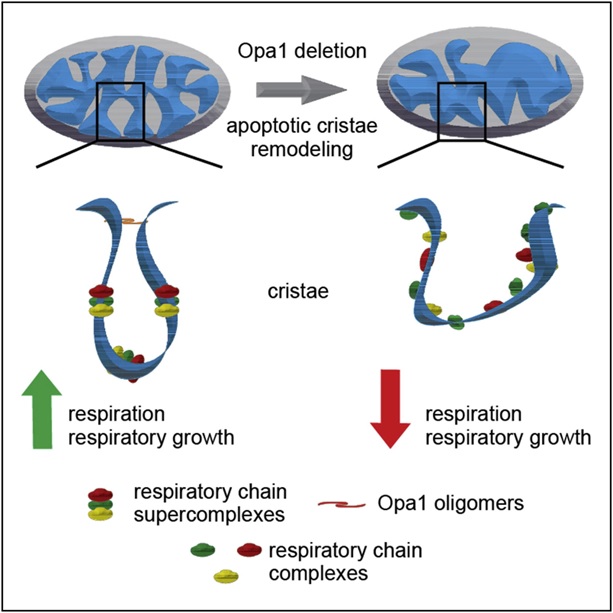
Figuur 1. Ongeorganiseerd membraan veroorzaakt door gebrek aan OPA1. Met aanpassingen overgenomen van Cogliati (2013)
Naast een verminderde energieproductie gaat een gebrek aan OPA1 gepaard met een overmatige productie van toxische moleculen, de zogenaamde reactieve zuurstofspecies (ROS). Normaal gesproken is er een adequaat niveau van ROS, maar als OPA1 ontbreekt, is er te veel ROS. Dit wordt weergegeven in figuur 3.
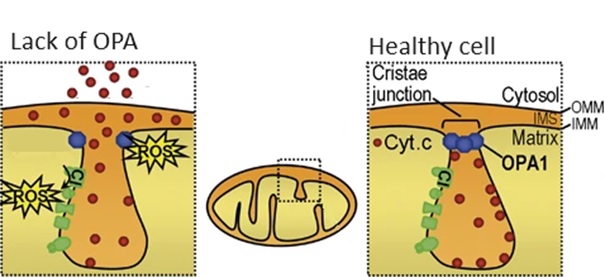
Figuur 2 Regeling van ROS door OPA. Met aanpassingen overgenomen van Ramonet (2013)
Bovendien wordt de fusie van twee verschillende mitochondriën met elkaar, een voorwaarde voor het goed functioneren en in stand houden van mitochondriën, verstoord (figuur 3). Dit is vooral belangrijk wanneer mitochondriën beschadigd zijn. Veel van de resterende functie kan worden gered als de mitochondriën samensmelten met een gezond mitochondrium. Als samensmelting niet mogelijk is door het ontbreken van OPA1, hopen defecte mitochondriën zich op. Wanneer een cel veel defecte mitochondriën heeft, treedt celdood op en bij ADOA sterven de RGC’s af, wat leidt tot verminderd gezichtsvermogen. In wezen beschermt voldoende OPA1 dus tegen celdood.
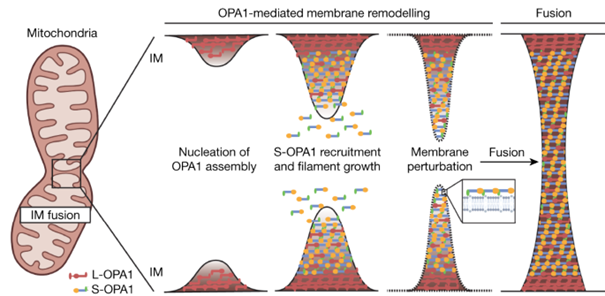
Figuur 3 De rol van OPA1 in het samensmelten van (beschadigde) mitochondriën.
Andere belangrijke functies van OPA1 zijn het handhaven van een gezond niveau van calciumionen in de cel en de bescherming van het mitochondriale DNA. Dit laatste bevat het bouwplan voor mitochondriën en is nodig wanneer er iets gerepareerd moet worden (Leaners et al., 2020). Al deze processen worden negatief beïnvloed wanneer de vernieuwing van het binnenste mitochondriale membraan verstoord is door een gebrek aan intact OPA1.
Een ander belangrijk aspect zijn de details van ATP-productie, weergegeven in Figuur 4. ATP wordt geproduceerd in de langgerekte buizen binnen de mitochondriën, door mitochondriale energieproducerende complexen. Het energieproducerende complex bestaat uit opeenvolgende complexen, complex 1-5, waarbij 5 het energiemolecuul ATP produceert. In de complexen worden elektronen overgedragen van het ene complex naar het volgende. Een belangrijke molecule hierbij is het co-enzym Q, (Q in figuur 3), dat complex 1-2 met 3 verbindt.

Figuur 4 ATP-productie en het energieproducerende complex. Andrieux (2021)
Idebenone
Hoewel men dacht dat Idebenone een rol speelde bij het direct mogelijk maken van ATP-productie, suggereert recent onderzoek dat het vooral andere rollen heeft (Gueven et al, 2020). Deze zijn (1) het vervoeren van ATP-bouwstenen naar de mitochondriën, (2) het stabiliseren van het mitochondriale membraan en (3) het verminderen van ROS. Idebenon verhoogt de niveaus van ROS-ontgiftende enzymen, die overtollige ROS elimineren en zo de mitochondriën beschermen.
Idebenone werd in eerste instantie ontwikkeld als een synthetische versie van het co-enzym Q10/ (ook Ubiquinone genoemd) analoog met een betere toegankelijkheid tot alle “regio’s” (compartimenten) van een cel. Het natuurlijke co-enzym Coenzym Q10 staat bekend om zijn cruciale rol bij de productie van energie en de bescherming tegen de hierboven genoemde giftige moleculen die ROS worden genoemd. Tegelijkertijd heeft natuurlijk co-enzym Q10 het nadeel dat het zijn doel in de cel niet bereikt, vandaar de behoefte aan een synthetische versie. Ondanks dat Idebenone structurele kenmerken deelt met het natuurlijke co-enzym Q10, verschilt het belangrijkste werkingsmechanisme van dat van Q10 (Gueven et al. 2015, Gueven et al., 2020). Net als Q10 is Idebenone waarschijnlijk in staat om ATP = energieproductie te ondersteunen (door direct elektronen over te dragen aan complex II en III van de energieproductieketen). Bovendien kan Idebenone, in tegenstelling tot Q10, energie-equivalenten (=ATP-precursoren) die in de celvloeistof werden geproduceerd naar de mitochondriën verplaatsen om de ATP-output te verhogen (Gueven et al. 2015).
Verder stellen Gueven et al. 2020 dat het belangrijkste beschermende mechanisme van Idebenone de afname van toxische vrije radicalen is door een effectiever mechanisme dan Q10 doet: Idebenone reageert niet alleen direct met vrije radicalen en ruimt ze daardoor op, zoals Q10 doet, maar verhoogt bovendien de niveaus van vrije radicalen neutraliserende enzymen (stel je ze voor als kleine machines). Deze ontgifting beschermt gevoelige celonderdelen zoals kern- en mitochondriaal DNA of lipiden. Daarnaast zijn er de volgende aanwijzingen die meer onderzoek vereisen: Idebenone bevordert “stamceleigenschappen” van een cel (mogelijk interessant voor regeneratie van RGC/optische zenuw), bevordert de overleving van cellen, verhoogt de niveaus van de ketenproteïnen voor energieproductie, verhoogt het aantal mitochondriën binnen een cel en vermindert de stress van het endoplasmatisch reticulum (een ander belangrijk celorganel) (Gueven et al., 2020).
Medisch bewijs
De biologie is vrij complex, maar de belangrijkste vraag is: werkt het echt? In Europa heet het geneesmiddel Raxone en wordt het geproduceerd door Chiesi. Raxone is goedgekeurd als medicijn voor de erfelijke neuropathie van Leber, die overeenkomsten heeft met ADOA. Er zijn verschillende onderzoeken geweest om te onderzoeken of Raxone voordelen heeft voor ADOA-patiënten. Raxone heeft verschillende extra moleculen (hulpstoffen) die Idebenone kunnen helpen om zijn doel te bereiken. Zoals alle medicijnen heeft het bijwerkingen, die in het recept worden beschreven. Hier richten we ons alleen op het effect van Raxone op de ogen.
Om deze onderzoeken te begrijpen, is het nodig om te kijken naar de methoden waarmee medisch bewijs wordt gegenereerd. De meest voorkomende metingen zijn gezichtsscherpte en kleurwaarneming.
Gezichtsscherpte wordt meestal gemeten op een kaart zoals de onderstaande (Afbeelding 5). Gezichtsvermogen wordt vaak weergegeven in decimalen (0 totale duisternis tot 1 perfect zicht).

Afbeelding 5. Snellen-kaart die in veel dokterspraktijken te vinden is.
Een andere manier om gezichtsscherpte te meten is de logMAR. Deze gaat van (1 bovenste rij tot 0) onderste rij.

Afbeelding 6 Een grafiek met logMAR-scores.
Kleurwaarneming wordt ook getest met een kleurentest. Figuur 7 hieronder toont zo’n test.

Figuur 7. Kleurwaarnemingstest.
Daarnaast worden vragenlijsten gebruikt en omgezet in 1-100 scores om de kwaliteit van leven van de patiënt te beoordelen, bijvoorbeeld ervaring met dagelijkse activiteiten, autorijden, enz.
De onderzoeken
Er zijn drie onderzoeken naar de effectiviteit van Idebenone, het eerste (Barboni et a. 2013), het tweede (Romagnoli 2020) en het derde (Valentin et al 2023).
Barboni gaf idebenone aan 7 patiënten en voerde een jaar later een meting uit. Het gezichtsvermogen wordt vaak weergegeven in decimalen (0 totale duisternis tot 1 perfect zicht).(Barboni et a. 2013) toonden aan dat er gemiddeld een verbetering was van 0,05 in het linkeroog en een verschil van 0,09 in het rechteroog. Er was ook enige verbetering in kleurwaarneming.
Romagnoli deed een veel groter onderzoek, met 87 patiënten, waarbij 50 patiënten werden behandeld met Idebenone en 37 niet. De patiënten werden 3-4 jaar gevolgd. Het vergelijken van patiënten met niet-behandelde patiënten heeft het voordeel dat je een idee krijgt van wat er met de behandelde patiënten zou zijn gebeurd als ze geen Idebenone hadden gekregen. In wezen vergeleken de onderzoekers Idebenone met het natuurlijke verloop van de ziekte. Deze studie heeft een andere methode gebruikt om naar de gezichtsscherpte te kijken, logMAR, die gaat van 1 (bovenste rij tot 0 (onderste rij). Gemiddeld vond (Romagnoli 2020) een verschil van 0,01 logMAR (ongeveer 0,5%), en het was onwaarschijnlijk dat dit verschil door toeval werd veroorzaakt. Tegelijkertijd hebben de onderzoekers gevonden dat in de Idebenone-groep meer patiënten gestabiliseerd (of licht verbeterd) bleken te zijn dan in de groep zonder Idebenone.
De derde studie, van Valentin, gaf Idebenone aan 16 patiënten en volgde hen een jaar lang. Ook hier werd logMAR gebruikt, (Valentin et al 2023) en er werd een verbetering van 0,08 voor het rechteroog en 0,06 voor het linkeroog gevonden. Valentin en collega’s keken ook naar het gezichtsveld (welk deel van het oog ziet goed) en vonden na 9 maanden een significante verbetering. Er was ook een significante verbetering van de kwaliteit van leven, waarbij patiënten meer activiteiten op afstand konden doen en beter in staat waren om auto te rijden (Valentin et al 2023).
Over het geheel genomen is het medische bewijs tot nu toe licht positief, maar nogal onduidelijk, en er zouden meer onderzoeken nodig zijn om definitief bewijs van effectiviteit te leveren. We weten ook niets over de effectiviteit op lange termijn, en dit is belangrijk omdat als Idebenone daadwerkelijk in staat is om het gezichtsvermogen gedurende een aantal jaren te stabiliseren (of mogelijk licht te verbeteren), dat inderdaad zeer nuttig zou zijn. Aan de andere kant kan de verbetering tijdelijk zijn, gevolgd door een relatief snellere achteruitgang. We hebben verschillende keren contact gehad met Chiesi en daar hebben ze geen plannen om naar ADOA te kijken bij deze ziekte. Het hebben van duidelijk bewijs is in veel landen noodzakelijk om de kosten van een medicijn te vergoeden (VK, Nederland, Zweden, enz.). Tegelijkertijd kan Raxone worden voorgeschreven in andere gezondheidssystemen, zoals Duitsland.
Zelfmedicatie
Als een bepaald farmaceutisch middel niet verkrijgbaar is in een land, kan zelfmedicatie een optie zijn. Idebenone is in veel landen ook verkrijgbaar als voedingssupplement. De Cure ADOA Foundation heeft een onafhankelijk laboratorium gevraagd het voedingssupplement te testen en het te vergelijken met Raxone. De hoeveelheid Idebenone lijkt hetzelfde te zijn. Er kunnen verschillen zijn in de manier waarop de molecule het doel bereikt, het is mogelijk dat Raxone een targeting systeem heeft dat helpt om het doel te bereiken, wat misschien niet aanwezig is in het voedingssupplement. Maar door de onzekerheid over hoe Idebenone precies werkt, kunnen de (beperkte) voordelen van Idebenone zich ook voordoen zonder het afgiftesysteem in Raxone om het doel te bereiken. Samenvattend: hoewel er geen algemene risico’s lijken te zijn, is dit ook geen wondermiddel en blijft ADOA een aandoening die nog niet is opgelost.
Referenties
Andrieux, Pauline, et al. “Mitochondria as a cellular hub in infection and inflammation.” International journal of molecular sciences 22.21 (2021): 11338
Barboni, Piero, et al. “Idebenone treatment in patients with OPA1-mutant dominant optic atrophy.” Brain 136.2 (2013): e231-e231.
Cogliati, Sara, et al. “Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency.” Cell 155.1 (2013): 160-171
Gueven, Nuri, Krystel Woolley, and Jason Smith. “Border between natural product and drug: comparison of the related benzoquinones idebenone and coenzyme Q10.” Redox biology 4 (2015): 289-295.
Gueven, Nuri, et al. “Idebenone: When an antioxidant is not an antioxidant.” Redox biology 38 (2021): 101812.
Ramonet, D., et al. “Optic atrophy 1 mediates mitochondria remodeling and dopaminergic neurodegeneration linked to complex I deficiency.” Cell Death & Differentiation 20.1 (2013): 77-85
Romagnoli, Martina, et al. “Idebenone increases chance of stabilization/recovery of visual acuity in OPA1‐dominant optic atrophy.” Annals of clinical and translational neurology 7.4 (2020): 590-594.
Valentin, Katharina, et al. “Idebenone Treatment in Patients with OPA1-Dominant Optic Atrophy: A Prospective Phase 2 Trial.” Neuro-Ophthalmology 47.5-6 (2023): 237-247.
von der Malsburg, Alexander, et al. “Structural mechanism of mitochondrial membrane remodelling by human OPA1.” Nature 620.7976 (2023): 1101-1108



