Hoe werken klinische studies bij ADOA?
Op dit moment staan verschillende bedrijven op het punt om klinische onderzoeken te starten (PYC, Stoke, enz.). Deze zijn nodig om aan te tonen dat hun behandeling daadwerkelijk werkt. Maar welke stappen moeten worden genomen voordat een medicijn door uw arts kan worden voorgeschreven?
Voordat een farmaceutisch bedrijf klinische studies bij mensen kan beginnen, moeten de onderzoekers eerst hun laboratoriumgegevens die zijn verkregen uit weefsel- en dierstudies indienen bij een regelgevende instantie. In de VS dienen farmaceutische bedrijven hun gegevens in als onderdeel van een aanvraag voor een Investigational New Drug (IND) bij de Food and Drug Administration (FDA). In Europa is dit een Investigational Medicinal Product Dossier (IMPD) en wordt ingediend bij het European Medicines Agency (EMA). Na een succesvolle aanvraag kan een klinisch onderzoek beginnen.
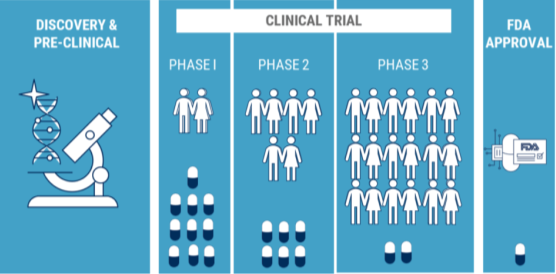
Figuur 1. Klinische studies https://www.centerforcognitivehealth.com/clinical-trial-myths-vs-facts/
Onderzoeken bestaan meestal uit drie fasen: de eerste-in-mens- of fase 1-onderzoeken, fase 2-onderzoeken naar veiligheid en werkzaamheid en fase 3 werkzaamheids-onderzoeken. De eerste fase bepaalt of een nieuw medicijn of behandeling veilig is. Als het medicijn of de behandeling als onveilig wordt beschouwd, of als het zeer ongewenste bijwerkingen heeft, zal het onderzoek mislukken en zal het niet doorgaan naar aanvullende tests. Omdat bijwerkingen vaak afhankelijk zijn van de medicatiedosis, wordt ook tijdens deze fase de optimale dosering bepaald. Als een medicijn deze fase succesvol doorstaat, kan het doorgaan naar de volgende fase, fase 2, om de werkzaamheid te testen. Bij het bestuderen van een zeldzame ziekte zoals ADOA is het vaak moeilijk om patiënten te werven om deel te nemen, daarom worden deze onderzoeken soms gezamenlijk uitgevoerd als een gecombineerd fase 1/fase 2-onderzoek. Omdat de natuurlijke progressie van ADOA langzaam is, kost het tijd om het effect van een medicijn of behandeling te beoordelen, dus een onderzoek kan vier jaar duren met meerdere beoordelingen gedurende die periode. Als er enig effect is, wordt de omvang van het effect geëvalueerd in een fase 3 klinisch onderzoek. In deze laatste fase worden de patiënten in twee groepen verdeeld, waarbij het opgooien van een munt bepaalt of een patiënt een behandeling of een nepbehandeling ontvangt (een behandeling die niet kan worden onderscheiden van de echte, maar zonder werkzame stof). Dit stelt onderzoekers in staat om 1) rekening te houden met het feit dat patiënten vaak verbetering ervaren door de nepbehandeling en 2) de twee groepen te vergelijken om verbetering te beoordelen, of in het geval van ADOA, de visuele functie van degenen die de behandeling hebben ontvangen versus degenen die denken dat ze deze hebben ontvangen.
Omdat er momenteel geen behandelopties zijn voor ADOA, hoeft het eerste bedrijf met een effectieve behandeling niet per se alle 3 fasen te voltooien voordat het een marktgoedkeuring aanvraagt. Als er vroege tekenen van verbetering zijn tijdens een doeltreffendheidsonderzoek, en vooral als de verbetering groot is, kan het farmaceutische bedrijf proberen om vroegtijdige marktgoedkeuring aan te vragen. Dus bijvoorbeeld, als een onderzoek vier jaar duurt, maar er na twee jaar gegevens zijn die de werkzaamheid van het product aantonen, kan een bedrijf mogelijk een vroegtijdige marktgoedkeuring aanvragen terwijl het onderzoek nog steeds doorgaat.
Hoewel standaardtesten meestal bestaan uit het kijken naar veranderingen in het visuele functioneren van een persoon, zijn er andere maatstaven om de doeltreffendheid van een medicijn of behandeling te beoordelen. Zoals we weten, begint het ADOA-ziekteproces met verminderde OPA-1-proteïne, wat op zijn beurt leidt tot verminderde mitochondriën, wat leidt tot schade aan cellen, wat leidt tot veranderingen binnen de oogzenuw en uiteindelijk tot verlies van het gezichtsvermogen. Voordat het gezichtsverlies optreedt, vinden er meerdere fysiologische veranderingen plaats, dus het is mogelijk om naar vroege markers te zoeken, zoals de mitochondriën van een persoon of de aanwezigheid van beschadigde retinale ganglioncellen. Het vermogen om naar deze markers te kijken, zou vooral nuttig zijn voor vroegtijdige detectie van de ziekte, vooral bij degenen met bekende OPA-1-mutaties die nog geen visuele symptomen hebben. Deze informatie zou mogelijk kunnen helpen bij het begeleiden van behandelingsbeslissingen en bepalen of een therapie geschikt zou zijn om mee te beginnen.
Zodra een medicijn als veilig wordt beschouwd voor volwassenen, kan een bedrijf aanvullende tests uitvoeren om de veiligheid bij kinderen vast te stellen. Dit proces zou beginnen met kinderen in de leeftijd van 12-18 jaar, gevolgd door een jongere bevolking, enzovoort. Maar dit kan allemaal niet gebeuren totdat de veiligheidstests voor volwassenen zijn voltooid, en soms zijn er zelfs meer gegevens nodig volgens de regelgevende instanties voordat wordt overgegaan tot tests bij kinderen.
Het is belangrijk op te merken dat toegang tot de markt niet het einde van het verhaal is. Gentherapie kan bijzonder duur zijn, waarbij sommige behandelingen honderdduizenden of miljoenen euro’s/dollars kosten. Hoewel artsen dergelijke behandelingen kunnen voorschrijven, is het betalen ervan voor slechts enkelen weggelegd, daarom is het belangrijk dat gezondheidsstelsels en verzekeringsmaatschappijen de behandelingen vergoeden. Gezondheidsstelsels hebben aanvullende eisen voor vergoeding, ze kunnen aanvullende studies of analyses van de farmaceutische bedrijven willen.




