De weg naar behandeling 19
ADOA en ADOA+
Op onze Jubileum dag op 18 november in Doorn heeft René de Coo van de Nemo Mitochondriële geneeskunde groep, afdeling Toxicogenomics van de Universiteit van Maastricht de werking van ADOA+ toegelicht, en de weg naar de behandeling.
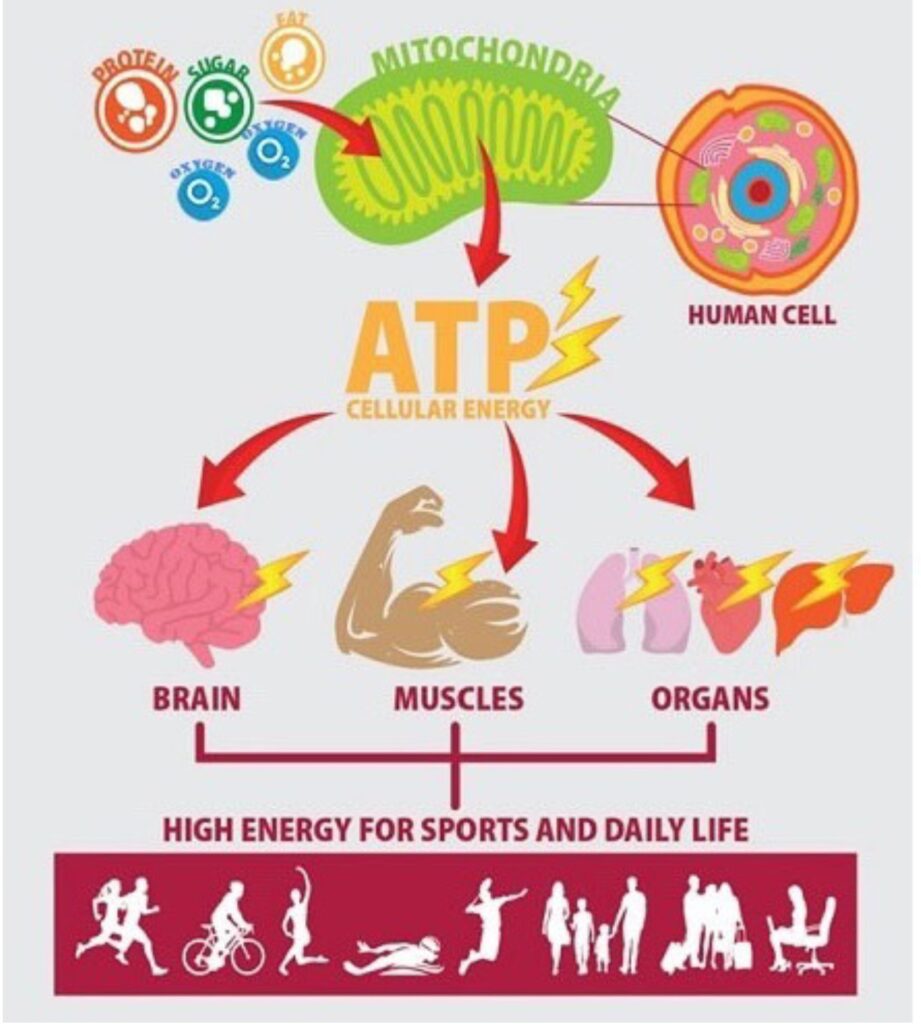
ADOA is een mitochondriële ziekte, waarbij de energiefabriekjes in de cel, de mitochondriën zijn aangetast. Mitochondriën maken de ATP-molecule aan, die nodig is om de cellen met energie te voorzien (Figuur 1). De cellen in de oogzenuw, de Retinale Ganglion Cellen (RGCs) hebben erg veel energie nodig, waardoor het energiedefect juist daar tot schade leidt. Beschadigde oogzenuwcellen leiden ook tot een bleekheid van de oogzenuw, een symptoom van atrofie.
In 20-30% van de gevallen is er sprake van ADOA+, waarbij er meer schade ontstaat dan alleen bij de oogzenuw. Belangrijkste symptomen zijn gehoorverlies, CPEO, spierlijden, perifeer zenuw problemen, minder stuur, spasticiteit van de benen en star.

Bij de OPA mutatie wordt de OPA1 molecule verkeerd aangemaakt, waardoor OPA1 de normale functies niet kan vervullen. Hierdoor zijn de mitochondriën beschadigd. In een gezonde cel zijn mitochondria voortdurend aan het splitsen (fission) en samensmelten (fusion), waarbij zelfs beschadigde mitochondriën zichzelf uitschakelen en door opruimorganellen worden opgegeten (linkerkant van Figuur 2).
Aan de rechterkant van Figuur 2 laat zien hoe dit eruitziet in een cel met een beschadigde OPA1 gen. OPA1 molecule heeft een belangrijke rol bij de fusie van mitochondriën, en als die niet goed is aangemaakt, kunnen de mitochondriën niet samensmelten, alleen splitsen. Uiteindelijk worden de kleine beschadigde mitochondriën opgeruimd (mitophagie).
In 70% van de gevallen leidt dit tot optische atrofie. Bij ADOA+ kan er sprake zijn van meer dan beschadigd gezichtsvermogen. Bijvoorbeeld, iemand kan bij de diagnose last hebben van een hangend ooglid. Dat kan al ADOA+ zijn, afhankelijk van familiegeschiedenis, en het resultaat van aanvullend onderzoek. De resultaten van deze onderzoeken zijn erg uiteenlopend, maar er is bij ADOA+ altijd sprake van aanvullende (zenuw-)schade ergens in het lichaam.
ADOA+ heeft te maken met een net andere mutatie dan bij reguliere ADOA. Het gen heeft de codering van de eiwitten, en deze worden weergegeven met letters, zoals in een zin. Bij een gezond iemand is de zin volledig leesbaar, en het eiwit kan worden aangemaakt. Bij ADOA is er meestal sprake van dat een letter ontbreekt, of wordt toegevoegd (nonsense mutatie) waardoor de letters in de zin verkeerd staan, en de zin is niet meer te begrijpen. Hierdoor functioneert het eiwit niet meer. Bij ADOA+ is er vaak een verandering van een letter (missense mutatie) waarbij het gen wel af te lezen is maar de betekenis veranderd. Hierdoor wordt soms een echt eiwit gemaakt, die schadelijk is voor het lichaam. ADOA hangt vaker samen met het produceren van minder eiwit, bij ADOA+ wordt er een verstorend eiwit geproduceerd.
Bij ADOA+ is de ernst van de symptomen erg verschillend, 12% krijgt geen symptomen. Overerving via de vrouw verhoogd iets de kans op ADOA+, en er is een verhoogde kans op ADOA+ bij een mutatie in exon 14 van het OPA1 gen.
Op dit moment worden er voor ADOA verschillende geneesmiddelentherapieën ontwikkeld, en gentherapieën (Figuur 3). De geneesmiddel therapieën proberen de mitochondriële functie te herstellen. Sommige therapieën grijpen aan op de processen voor ATP-productie, zoals Q10, Idebenone, EPI-743), en daarmee de functie van de mitochondriën te herstellen. Andere proberen radicalen te verminderen (vitamine C, E, B2, B3, B12, foliumzuur), weer anderen proberen het aantal mitochondriën toe te nemen (bezafibrate, AICAR, roziglitazone, resveratrol), en anderen remmen de dood van de mitochondriën (rapamycin).
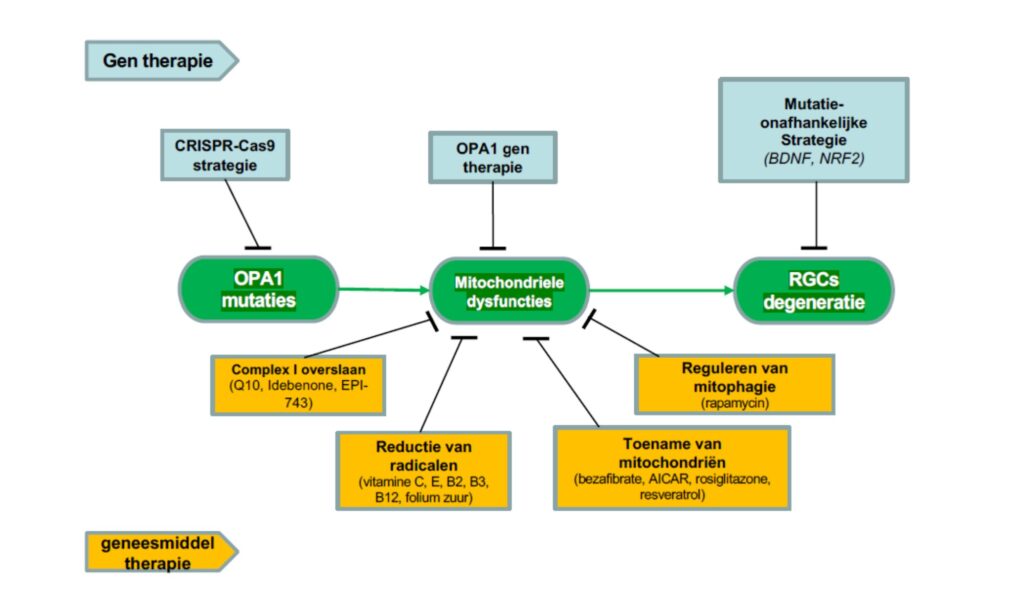
Van gentherapie zijn er een aantal die direct op de mutatie ingrijpen (CRISPr-Cas), anderen proberen de problemen bij de mitochondriën te verhelpen (OPA1 gentherapie), en er zijn mutatie-onafhankelijke strategieën die de RGC degeneratie willen stoppen (BDNS,NRF2).
Wat alle therapieën gemeenschappelijk hebben is dat die nog niet door een dokter voorgeschreven kunnen worden.
Los van behandeling van de huidige patiënten, is het ook belangrijk of het mogelijk is om in de toekomst ADOA niet over te erven op toekomstige generaties. Daar zijn mogelijkheden voor, en daarover kan een klinisch geneticus adviseren.
Bij ADOA+ is spierzwakte als een van de problemen. Op de Universiteit Maastricht is er een experiment uitgevoerd om de eigen spierstamcellen toe te dienen om spierzwakte te herstellen. Dit leek in beginsel veilig te zijn.
Samenvattend, er is nog geen therapie, maar er wordt veel onderzoek gedaan naar de behandeling van ADOA(+). De Universiteit Maastricht houdt zich bezig met onderzoek naar stamcellen die in de beschadigde cellen kan vervangen. Ondertussen is het belangrijk voor ADOA en ADOA+ patiënten om in beweging te blijven, dat beschermt ook de energiefabriekjes. Registratie van ADOA gen-mutatie en afstaan van huidcellen kan nu al een bijdrage leveren voor onderzoek, en verdere steun voor onderzoek blijft belangrijk.




